PRAKTIKUM TITIK BEKU LARUTAN //Kelompok 2 SMAS ADVENT NUSRA YouTube

1 .Sifat Koligatif Larutan _ c. Kenaikkan Titik Didih dan Penurunan Titik Beku Larutan YouTube
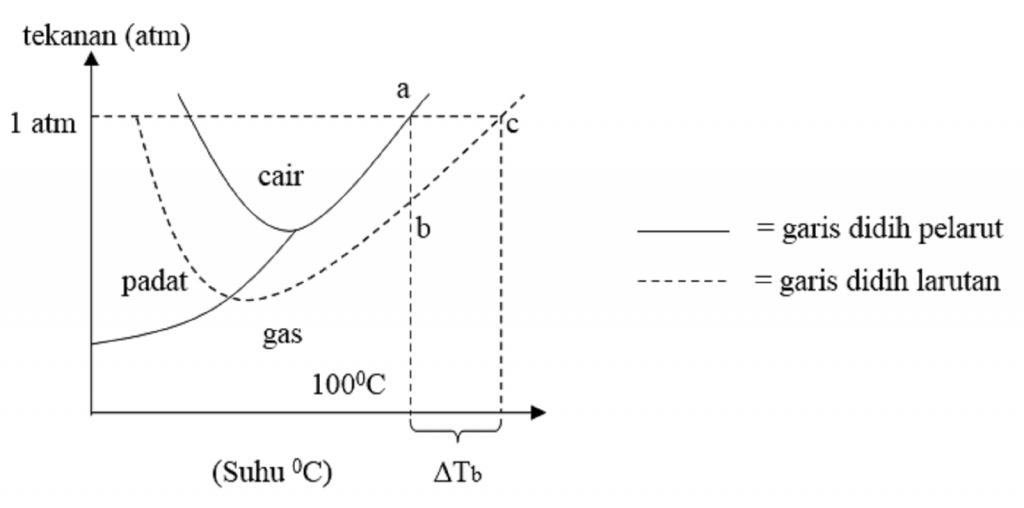
Penurunan titik beku adalah selisih antara titik beku pelarut dengan titik beku larutan. Penurunan titik beku ini termasuk salah satu sifat koligatif larutan. Dalam perhitungan kimia, penurunan titik beku disimbolkan dengan ΔT f (f berasal dari kata freeze) atau ΔT b . Peristiwa penurunan titik beku ini sering diterapkan pada negara-negara.
Modul I Sifat Koligatif Larutan Penurunan Titik Beku Larutan Mobile
Video ini membahas materi kimia Kelas XII MIPA yaituTitik Beku Larutan Non Elektrolit. Video ini dibuat untuk membantu siswa/i agar lebih memahami materi pel.

Larutan yang memiliki titik beku paling rendah adalah.
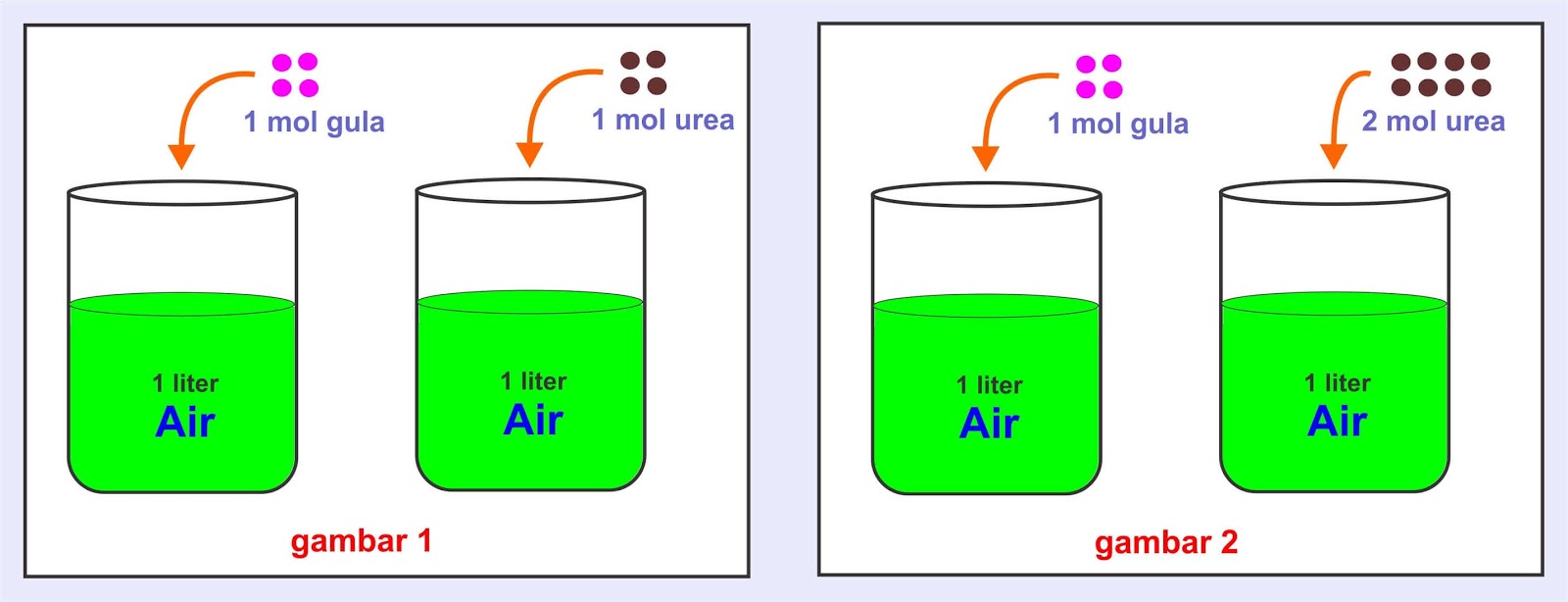
Sifat koligatif larutan itu ada empat macam, yaitu p enurunan tekanan uap (Δ P), penurunan titik beku (Δ Tf), kenaikan titik didih (Δ Tb), dan tekanan osmotik (π). Kenapa ya simbol dari keempat sifat koligatif larutan itu beda-beda? Terus, arti dari setiap simbolnya itu apa, sih? Eits! tenang, guys. Misteri itu akan kamu pecahkan, kok!

Contoh Soal Perbandingan Penurunan Titik Beku (Sifat Koligatif Larutan Elektrolit) YouTube
Titik beku. inggit prakasa. Apabila suatu zat dilarutkan dalam suatu pelarut, maka sifat larutan itu berbeda dari sifat pelarut murni. Contohnya, larutan urea yang berbeda sifat dengan air murni biasa. Sifat-sifat larutan yang ada, seperti rasa, warna, pH, dan kekentalan bergantung pada jenis dan konsentrasi zat yang terlarut.

Apa yang dimaksud dengan penurunan titik beku 2021
4. Jenis zat terlarut juga dapat mempengaruhi titik beku larutan, dengan zat terlarut yang lebih berat memiliki efek yang lebih besar pada titik beku larutan. 5. Kompleks yang terbentuk dari zat terlarut dapat membentuk lapisan yang melindungi molekul cairan dari pembekuan dan menyebabkan titik beku larutan turun. 6.

Praktikum Penurunan Titik Beku Pada Pembuatan Es Krim II Sifat Koligatif Larutan YouTube
Titik beku larutan = 0 °C - 18,6 °C = -18,6 °C. Titik beku larutan 64 gram naftalena dalam 100 gram benzena adalah 2,91 °C. Jika titik beku benzena 5,46°C dan tetapan titik beku molal benzena 5,1 °C, maka tentukan massa molekul relatif naftalena! Jawab: ΔTf = m × Kf ΔTf = massa benzena/Mr x 1.000/p x Kf

Perhatikan diagram PT air, larutan urea 0,1 m dan NaC...
Larutan yang dihasilkan atau campuran padatan-padatan tersebut memiliki titik beku lebih rendah daripada pelarut atau padatan murninya. Fenomena inilah yang menyebabkan air laut , (campuran garam [dan lainnya] dalam air) tetap cair pada suhu di bawah 0 °C (32 °F), titik beku air murni.

Membaca grafik titik didih dan titik beku larutan, pelarutsifat koligatif YouTube
Titik beku larutan ialah temperatur pada saat larutan setimbang dengan pelarut padatannya. Larutan akan membeku pada temperatur lebih rendah dari pelarutnya. Tujuan dari dilakukan praktikum ini adalah menentukan besarnya tetapan penurunan titik beku asam asetat dan menentukan berat molekul suatu zat non elektrolit. Praktikum ini dilakukan.

Rumus titik beku larutan
Tf0: titik beku pelarut murni Tf: titik beku larutan. Baca juga: Sifat Koligatif Larutan Elektrolit dan Faktor Vant Hoff . Dilansir dari Chemistry LibreTexts, penurunan titik beku bergantung pada jumlah total partikel terlarutnya. Sehingga, dapat dihitung melalui molalitasnya sebagai berikut: Dengan, ΔTf: penurunan titik beku m: molalitas.

Berikut disajikan data percobaan tentang titik beku beber...
T f = titik beku larutan. Penurunan titik beku larutan elektrolit. Rumus penurunan titik beku larutan elektrolit sebagai berikut: ΔT f = K f. m . {1 + (n - 1) α} Keterangan: n = jumlah ion; α = derajat ionisasi; Contoh soal dan pembahasan. Contoh soal 1. Sebanyak 2,4 gram urea (Mr = 60) dilarutkan dalam 50 gram air.

Penurunan Titik Beku Larutan Definisi Dan Penyebabnya Reverasite
Titik beku. Titik beku adalah suatu kondisi suhu saat zat cair berubah wujud menjadi padat. Adapun titik beku besarnya sama dengan titik lebur yakni 0°C. Titik lebur. Titik lebur atau titik leleh adalah suatu kondisi suhu saat benda padat meleleh menjadi cair. Sementara itu, titik lebur suatu zat dipengaruhi oleh: Tekanan

Berikut data titik beku (Tf) beberapa larutan elektrolit
Titik beku larutan lebih rendah daripada titik beku pelarut murni. Hal ini disebabkan zat pelarutnya harus membeku terlebih dahulu, baru zat terlarutnya. Jadi larutan akan membeku lebih lama daripada pelarut. Setiap larutan memiliki titik beku yang berbeda. Titik beku suatu cairan akan berubah jika tekanan uap berubah, biasanya diakibatkan oleh.
Sifat Koligatif Larutan Kenaikan Titik Didih Dan Penurunan Titik Beku Reverasite
Dapat dikatakan bahwa, larutan akan membeku pada temperatur yang lebih rendah. Baca Juga: Pengertian Senyawa Polimer. Nah, berdasarkan penjalasan tadi, dapat dinyatakan bahwa penurunan titik beku larutan adalah selisih antara titik beku pelarut dengan titik beku larutan. Besarnya penurunan titik beku larutan diberi lambang ∆T f.

Data percobaan penurunan titik beku Larutan Konsentrasi
3. Penurunan titik beku Titik beku adalah suhu pada tekanan tertentu yang menyebabkan perubahan zat dari cair ke wujud padat. Jika zat pelarut (air) dicampur dengan zat terlarut dan didinginkan hingga 0⁰C, ternyata larutan tersebut tidak membeku. Agar bisa beku, maka larutan harus didinginkan dengan suhu yang lebih rendah lagi.

PRAKTIKUM TITIK BEKU LARUTAN //Kelompok 2 SMAS ADVENT NUSRA YouTube
Penurunan Titik Beku. Penurunan titik beku larutan ditentukan oleh konsentrasi atau jumlah partikel zat terlarut dalam larutan. Semakin besar konsentrasi larutan, maka semakin besar pula penurunan titik bekunya. Ini disebabkan karena adanya molekul-molekul pelarut sulit berubah menjadi cair karena pergerakan pelarut dihalangi oleh terlarut.

Cara Menghitung Tetapan Penurunan Titik Beku Larutan (Kf) (UN Kimia 2018 No. 24) YouTube
Penurunan titik beku adalah salah satu sifat koligatif larutan yang dipengaruhi oleh beberapa faktor. Faktor-faktor yang mempengaruhi penurunan titik beku meliputi: Konsentrasi Partikel Terlarut: Semakin tinggi konsentrasi partikel terlarut dalam larutan, semakin besar penurunan titik beku yang terjadi. Ini berarti larutan dengan konsentrasi.