Pengertian Larutan Elektrolit Kuat dan Elektrolit Lemah Beserta Perbedaannya
Pasangan Larutan Berikut Yang Dapat Menghantarkan Arus Listrik Adalah YPHA.OR.ID
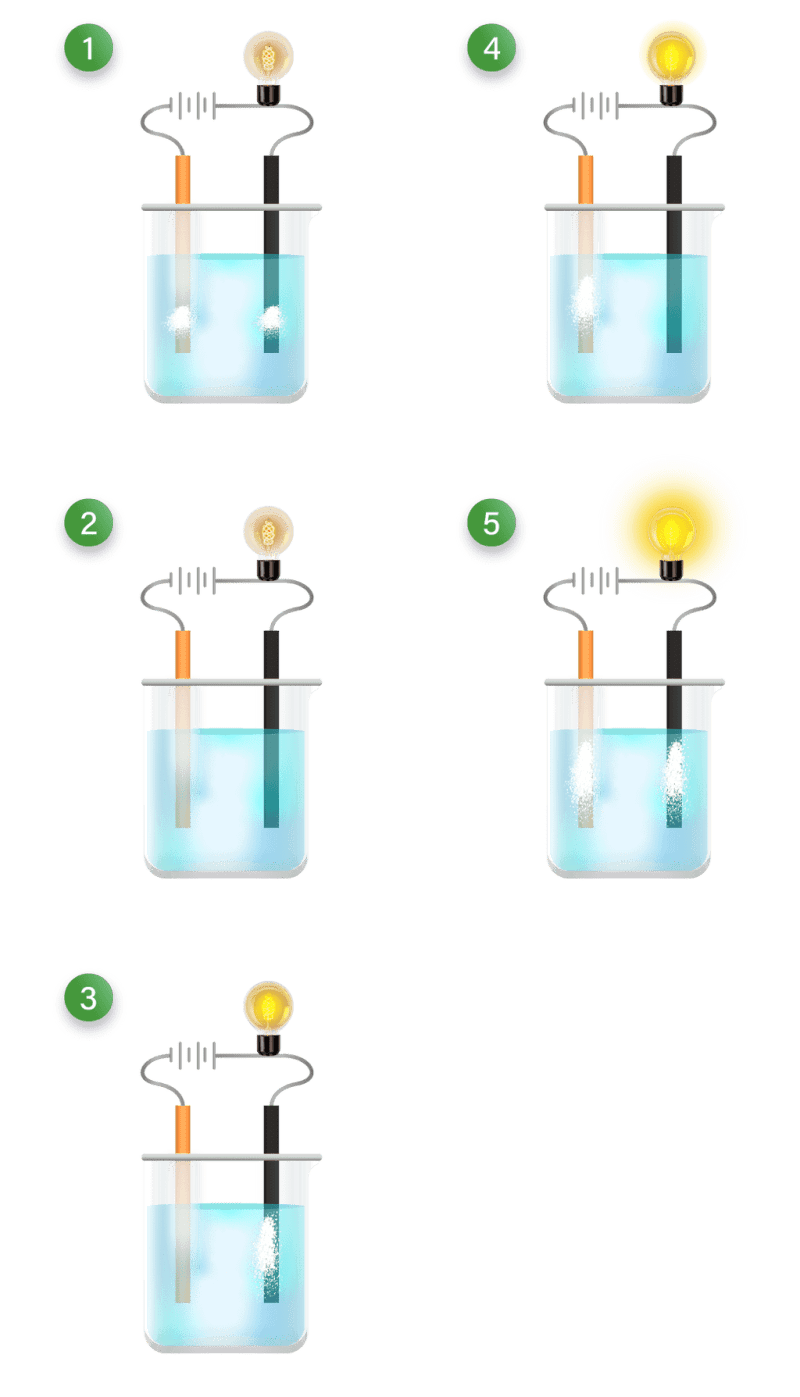
Larutan elektrolit dan non elektrolit memiliki karakteristik sifat yang berbeda. Perbedaannya adalah sebagai berikut: Sifat larutan elektrolit: Dapat menghantarkan listrik. Memiliki derajat ionisasi yang berkisar antara 0 < α ≤ 1. Jika dinyalakan uji daya hantar listrik: gelembung gas yang dihasilkan banyak, lampu menyala.

Larutan Elektrolit Dapat Menghantarkan Arus Listrik Karena?
Larutan elektrolit dapat menghantarkan listrik karena di dalam larutan ini terdapat ion-ion yang dapat bergerak secara bebas. Ion-ion itu lah yang menghantar arus listrik dalam larutan. Proses ionisasi pada larutan elektrolit sangat menentukan daya hantar listrik larutan elektrolit. Makin banyak ion dalam larutan, makin kuat daya hantar listriknya.
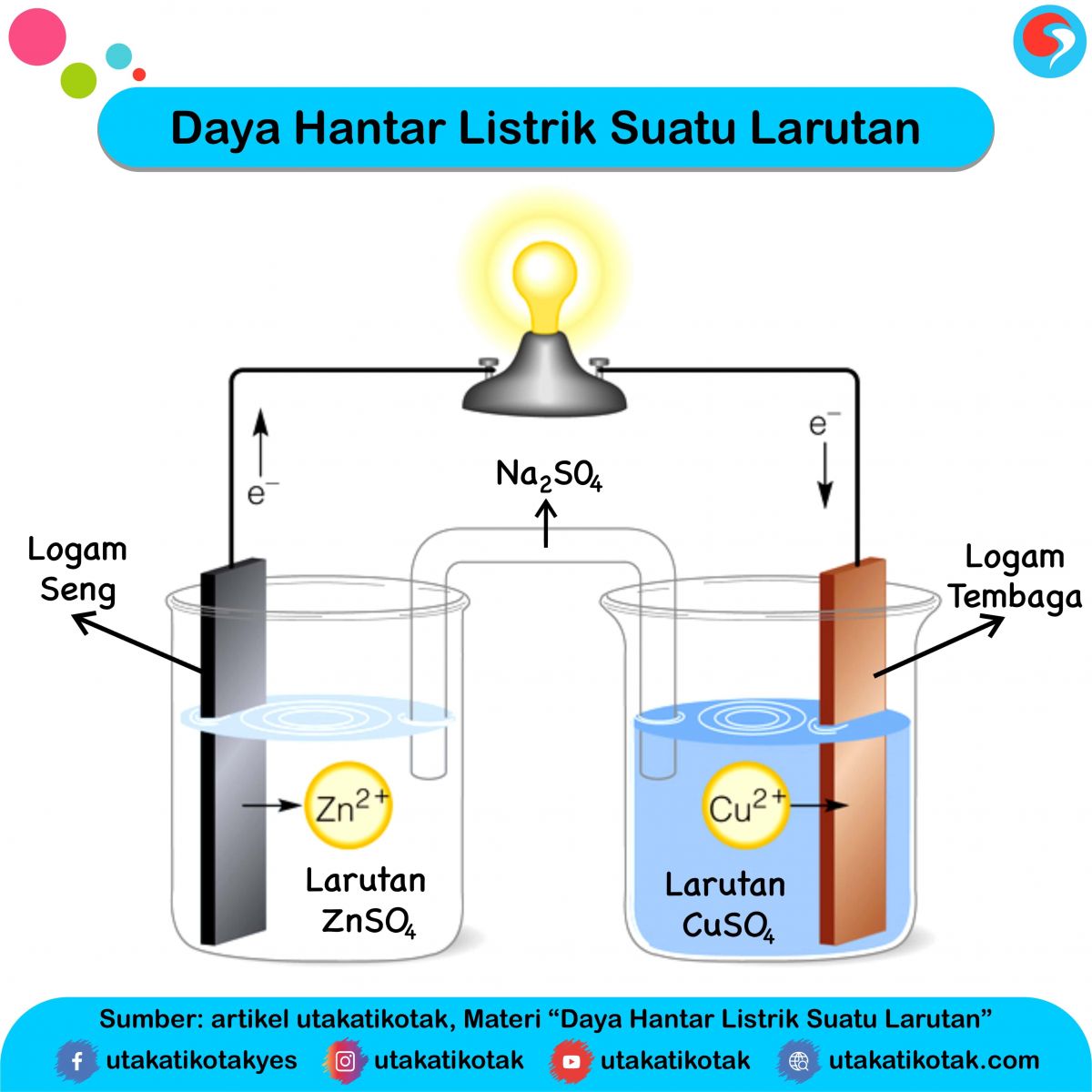
Daya Hantar Listrik Suatu Larutan
Karena larutan HClO 4 dan larutan HCl mengalami ionisasi sempurna didalam air, sehingga menghasilkan daya hantar listrik yang kuat. 10. HCl cair tidak menghantarkan arus listrik sedangkan larutan HCl dapat menghantarkan arus listrik. Dari fakta tersebut dapat di simpulkan bahwa…. a. arus listrik akan mengalir bila ada air sebagai mediumnya. b.
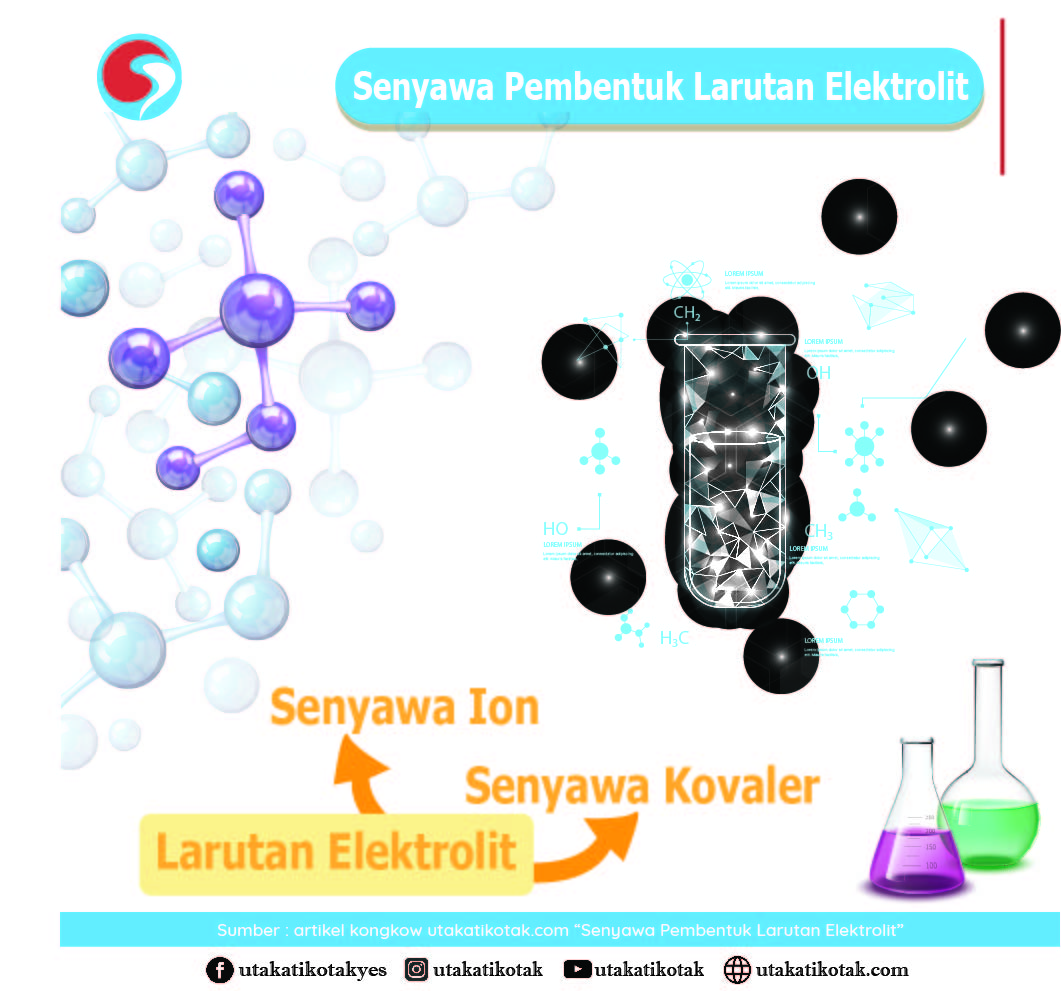
Senyawa Pembentuk Larutan Elektrolit
Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik karena zat larutan terurai menjadi partikel-partikel bermuatan (ion) yang bergerak bebas. Penerapan larutan elektrolit di sekitar kita diantaranya digunakan sebagai pengisi aki, baterai, dan minuman elektrolit. 1. Aki

Soal Larutan Elektrolit Dan Nonelektrolit Satu Trik
Larutan elektrolit cenderung membentuk larutan yang dapat menghantarkan listrik. Mengalami perubahan optik karena interaksi ion dengan molekul pelarut. Sifat Larutan Non Elektrolit. Larutan non elektrolit tidak dapat memisahkan diri menjadi ion-positif dan ion-negatif karena molekulnya tetap utuh dalam larutan.
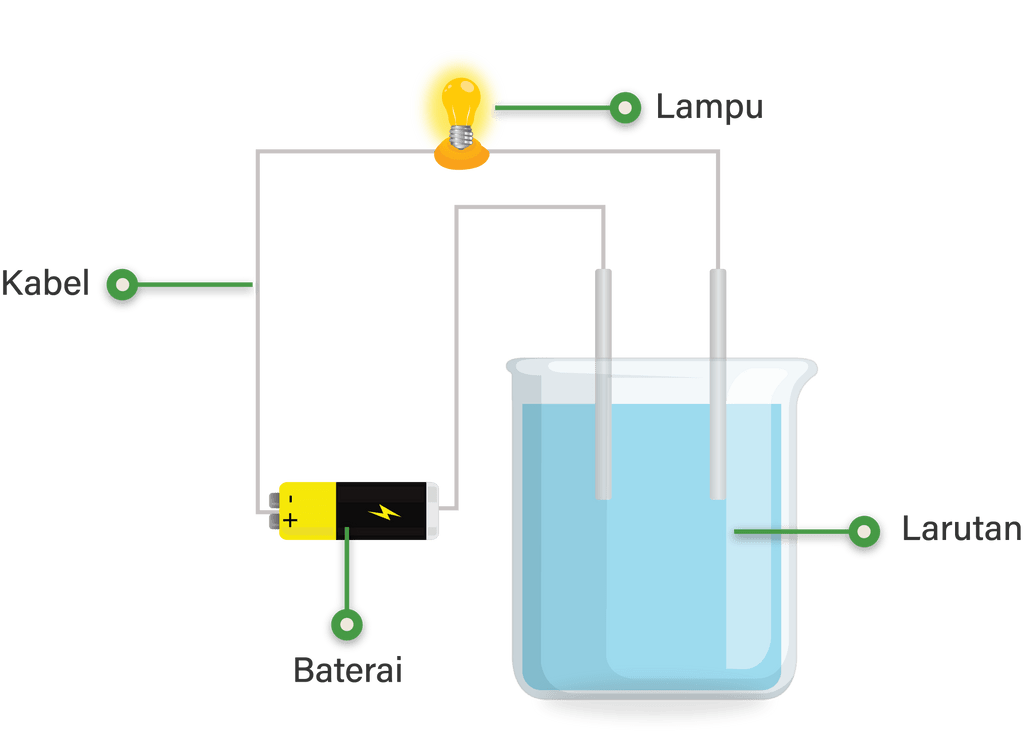
Bagaimana cara membedakan kemampuan suatu cairan d...
Kesimpulannya, larutan elektrolit mengandung ion yang dapat bergerak dan memberikan energi listrik. Oleh karena itu, larutan elektrolit dapat menghantarkan listrik dengan cepat dan digunakan dalam berbagai aplikasi. 2. Larutan elektrolit memungkinkan arus elektron bergerak dari satu titik ke titik lain.

30 Contoh Larutan Elektrolit dan Non Elektrolit
Sedangkan larutan yang tidak dapat menghantarkan arus listrik disebabkan karena zat-zat tersebut tetap berwujud molekul-molekul netral yang tidak bermuatan. Berdasarkan daya hantarnya larutan elektrolit terbagi menjadi dua, yaitu elektrolit kuat dengan daya hantar yang besar. Contohnya larutan asam kuat, basa kuat dan garam. yang kedua.

Memahami Elektrolit, Larutan yang Dapat Menghantarkan Listrik Sahitya.id
Karena larutan elektrolit dapat melepaskan ion ke dalam larutan, hal ini memungkinkan untuk menghantarkan arus listrik. Ketika arus listrik dilewatkan melalui larutan elektrolit, ion-ion positif dan negatif akan bergerak menuju elektroda yang berlawanan, menciptakan muatan listrik yang memungkinkan aliran listrik.

Larutan Elektrolit dan Non Elektrolit (Komponen Larutan)
Larutan elektrolit merupakan larutan yang dapat menghantarkan listrik karena terionisasi menjadi ion-ion yang dapat bergerak bebas. Berdasarkan kekuatan daya hantar listriknya, larutan elektrolit dibedakan menjadi elektrolit kuat dan elektrolit lemah. Larutan elektrolit berasal dari senyawa ionik dan sebagian senyawa kovalen polar.

Mengenal Larutan Elektrolit dan Non Elektrolit Kimia Kelas 10
NaCl (s) → Na+ (aq) + Cl− (aq) Perlu elo ingat bahwa larutan elektrolit kuat selalu terdiri dari asam kuat, basa kuat dan garam. Nah, larutan NaCl (garam) bukan satu-satunya yang tergolong ke dalam larutan elektrolit kuat. Karena terdapat beberapa larutan yang dapat menghantarkan arus listrik adalah NaOH (soda api), H2SO4 (asam sulfat), HCl.

Pengertian Larutan Elektrolit Kuat dan Elektrolit Lemah Beserta Perbedaannya
Larutan elektrolit dapat menghantarkan listrik karena mengandung ion-ion yang bergerak bebas. Ion-ion tersebut berperan menghantarkan arus listrik melalui larutan. Pada larutan elektrolit yang dilengkapi dengan elektroda dan rangkaian listrik, ion-ion negatif bergerak menuju elektroda yang bermuatan positif dan melepaskan elektron, kemudian ion.
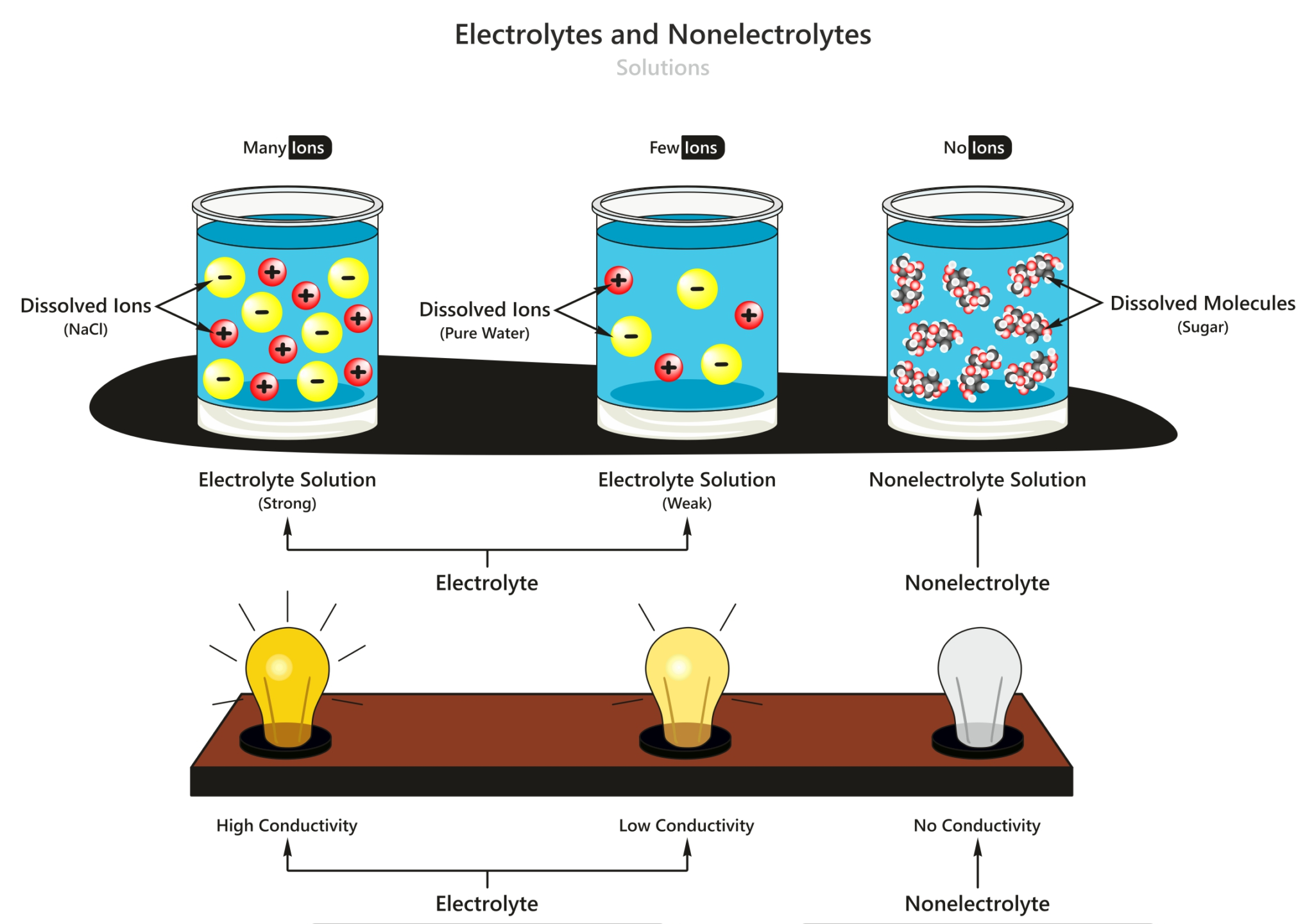
Larutan Elektrolit dan Non Elektrolit Materi Kimia Kelas 10
Cara Larutan Elektrolit Menghantarkan Listrik. Pada 1887, ilmuwan Swedia Svante August Arrhenius menjelaskan peristiwa hantaran arus listrik lewat larutan dengan teori ion. Dia berpendapat bahwa zat-zat elektrolit akan terurai menjadi ion-ion (terionisasi) jika dilarutkan dalam air. Ion tersebut bergerak bebas dalam larutan sehingga dapat.
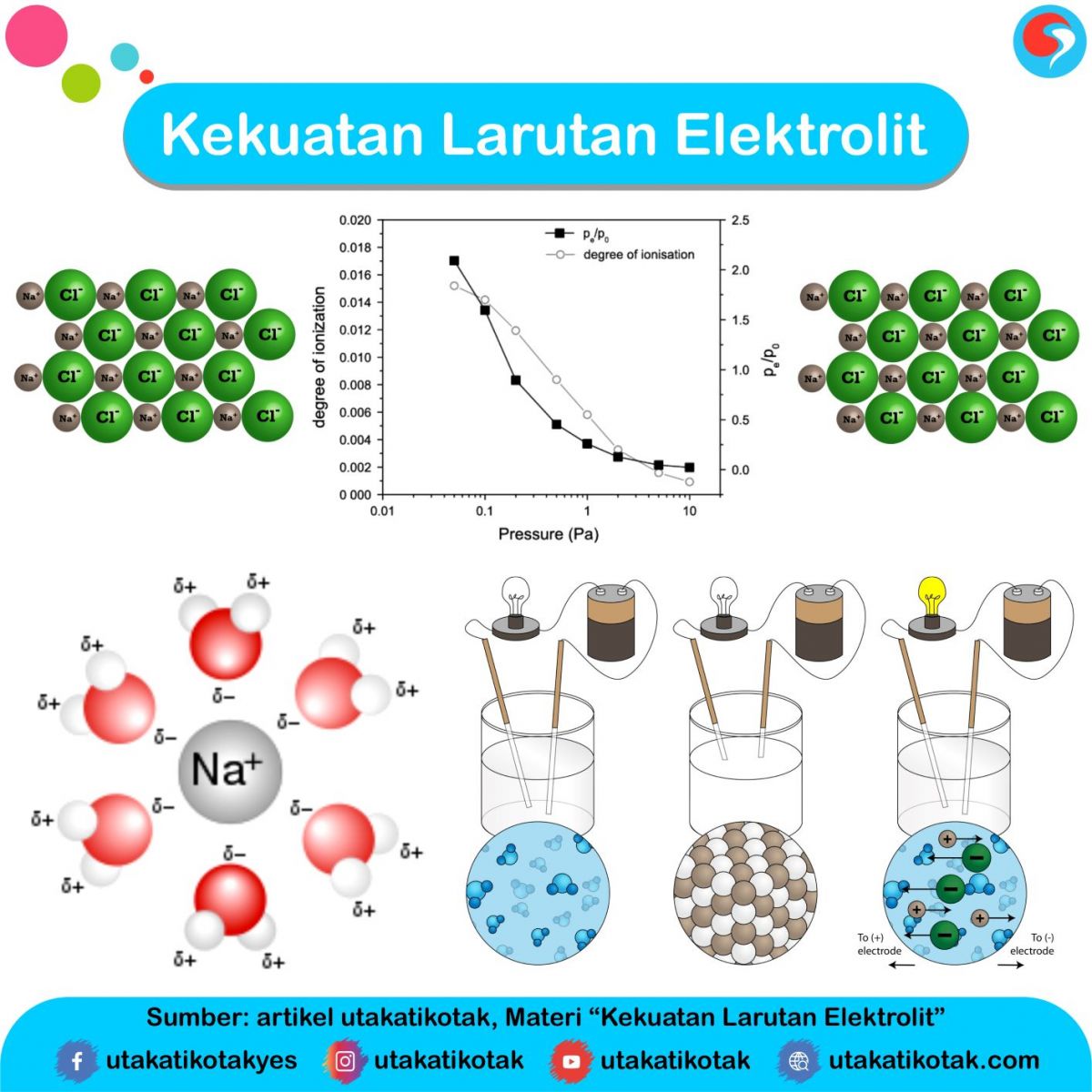
Kekuatan Larutan Elektrolit
Larutan elektrolit dapat menghantarkan arus listrik karena larutan elektrolit adalah larutan yang mengandung zat-zat yang dapat terionisasi atau terdisosiasi menjadi ion-ion positif dan negatif. Ion-ion ini dapat bergerak bebas dalam larutan dan membentuk arus listrik. Contoh larutan elektrolit adalah larutan garam, asam, basa, dan beberapa.
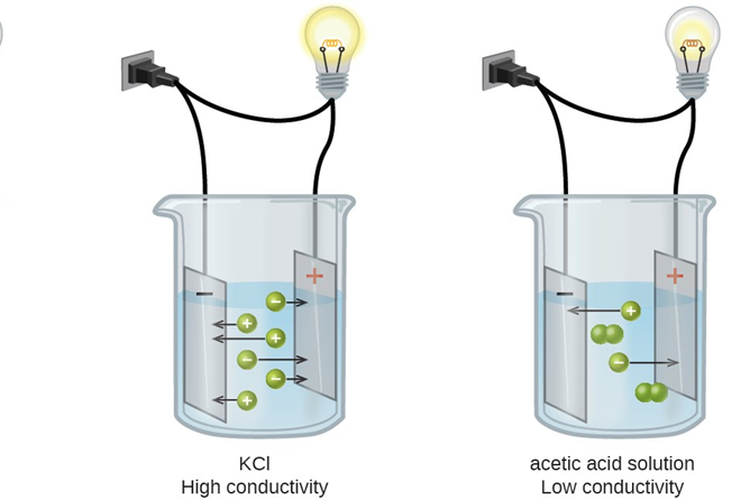
Contoh Larutan yang Dapat Menghantarkan Arus Listrik
Penjelasan Lengkap: mengapa larutan elektrolit mampu menghantarkan arus listrik. 1. Larutan elektrolit mampu menghantarkan arus listrik karena adanya ion-ion yang bergerak di dalamnya. Larutan elektrolit adalah larutan yang mengandung ion atau partikel yang dapat melepaskan elektron dan menghantarkan arus listrik.

Larutan Yang Dapat Menghantarkan Listrik Disebut Dengan Istilah Larutan baterai jam tangan
Sehingga, ion dapat bergerak bebas di dalam larutan elektrolit. Ion-ion yang bergerak bebas itulah yang menjadi kunci mengapa larutan elektrolit dapat menghantarkan listrik. Ketika larutan elektrolit di aliri listrik, muatan listrik akan di bawa oleh ion. Ion-ion akan bergerak bebas sembari membawa muatan listrik, mengakibatkan arus listrik.

Detail Contoh Elektrolit Kuat Dan Lemah Koleksi Nomer 6
a. Larutan elektrolit. Larutan elektrolit adalah larutan yang bisa menghantarkan arus listrik karena zat dapat terurai menjadi ion positif dan ion negatif. Larutan ini dibagi menjadi larutan elektrolit kuat dan elektrolit lemah dilihat dari kekuatan daya hantar listriknya. Larutan elektrolit kuat misalnya HCl, KCl, dan sebagainya.