Berikut disajikan data percobaan tentang titik beku beber...

PERCOBAAN III SIFAT KOLIGATIF LARUTAN PENURUNAN TITIK BEKU (Kimia Dasar I) Blog Najih
Gula: Konsentrasi (molal): 0,10 & 0,01 | Titik beku: -0,1860 & -0,0186 Berdasarkan data percobaan di atas, maka besarnya penurunan titik beku larutan ditentukan oleh.. A. Jenis zat terlarut B. Jumlah partikel zat terlarut C. Jenis larutan D. Jenis pelarut E. Perbedaan titik beku pelarut Jawaban: B

Data percobaan penurunan titik beku Larutan Konsentra...
Jadi, dapat disimpulkan bahwa penurunan titik beku dipengaruhi oleh jumlah partikel zat terlarut, semakin banyak partikel zat terlarut, maka semakin rendah titik beku larutan. Berdasarkan data pada tabel tersebut ada beberapa hal yang dapat disimpulkan mengenai titik beku larutan. Sebelumnya perhatikan bahwa urea (CO(NH2)2) dan sukrosa.

Data percobaan penurunan titik beku. Konsentrasi(m) Titik...
Sehingga penurunan titik bekunya akan lebih besar. Berdasarkan data tersebut tampak bahwa larutan NaCl (dapat mengion sempurna) memiliki nilai titik beku lebih rendah dibanding zat lainnya yang merupakan zat nonelektrolit (tidak mengion) pada konsentrasi yang sama. Konsentrasi molal juga berpengaruh pada zat yang sama, misalnya antara 0,01.

Pengertian Titik Beku Pada Suhu Zat Cair LABORATORIUM SMK
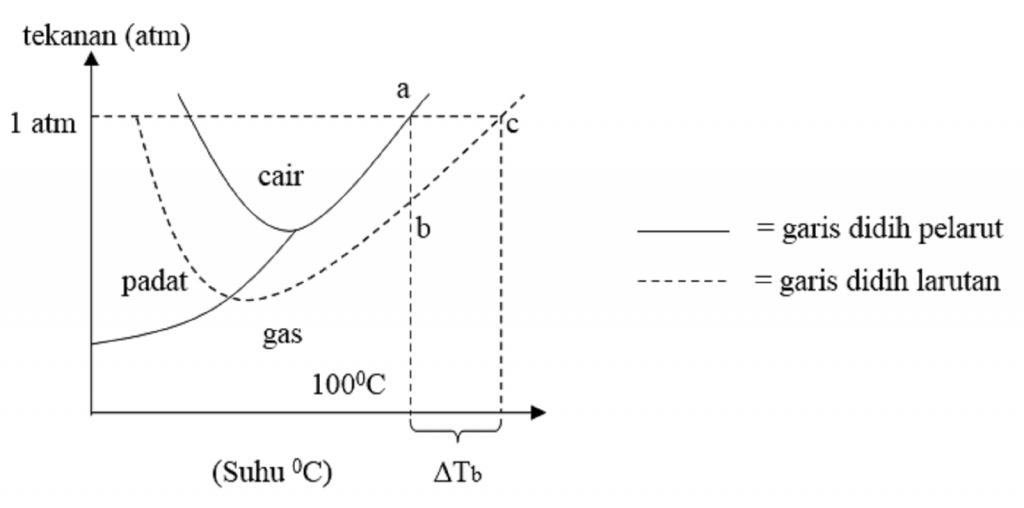
Selisih antara titik beku pelarut dengan titik beku larutan disebut penurunan titik beku (Δ Tf = freezing point depression). Pada percobaan ini ditunjukkan bahwa penurunan titik beku tidak bergantung pada jenis zat terlarut, tetapi hanya pada konsentrasi partikel dalam larutan. Oleh karena itu, penurunan titik beku tergolong sifat koligatif.

Diketahui data percobaan penurunan titik beku bebe...
Penurunan titik beku adalah penurunan titik beku pelarut akibat penambahan zat terlarut yang tidak mudah menguap. Contohnya termasuk penambahan garam dalam air, alkohol dalam air, atau pencampuran dua padatan seperti pengotor menjadi obat bubuk halus. Dalam kasus terakhir, senyawa yang ditambahkan adalah zat terlarut, dan padatan asli dianggap.

Rumus Penurunan Titik Beku Panduan Lengkap dan Detail
Pada sifat koligatif larutan penurunan titik beku berlaku rumus. Dari rumus diatas maka untuk penurunan titik beku dipengaruhi oleh molalitas (m), nilai Kf, dan faktor Van Hoff (i). Dari data tabel di atas semua larutan pada molalitas yang sama dan memiliki nilai Kf yang sama sehingga penurunan titik beku dipengaruhi oleh faktor Van Hoff.
Penurunan Titik Beku Larutan Tergantung Pada Reverasite
PENURUNAN TITIK BEKU Nina Fitriana*, Frista Irwaninda Lab. Kimia Fisika Jurusan Kimia Universitas Negeri Semarang Gedung D8 Lt 2 Sekaran Gunungpati Semarang, Indonesia, 50225 [email protected], 085770440465 Abstrak Percobaan ini dilakukan untuk menentukan tetapan penurunan titik beku asam asetat dan menentukan massa molekul relatif dari zat X. Metode yang digunakan dalam percobaan.

Percobaan Sifat Koligatif Penurunan Titik Beku YouTube
Penerapan sifat koligatif larutan yang berhubungan dengan penurunan titik beku larutan ditunjukkan oleh angka.. 1) dan 2) 1) dan 5) 2) dan 4) 3) dan 4) 4) dan 5) Multiple Choice. Edit. Please save your changes before editing any questions. 30 seconds. 1 pt. Perhatikan data percobaan titik didih beberapa larutan di atas!

Cara Menghitung Tetapan Penurunan Titik Beku Larutan (Kf) (UN Kimia 2018 No. 24) YouTube
Sifat Koligatif Larutan. Penurunan Titik Beku. Data percobaan penurunan titik beku: Larutan Konsentrasi (molal) Titik Beku (C) NaCl 0,1 -0,372 NaCl 0,2 -0,744 CO (NH2)2 0,1 -0,186 CO (NH2)2 0,2 -0,372 C6H12O6 0,1 -0,186 Berdasarkan data tersebut dapat disimpulkan bahwa penurunan titik beku tergantung pada (A) jenis zat terlarut (B) konsentrasi.

Praktikum Kimia Sederhana Penurunan Titik Beku 2 YouTube
Ikut Bimbel online CoLearn mulai 95.000/bulan.IG CoLearn: @colearn.id https://bit.ly/Instagram-CoLearnSekarang, yuk latihan soal ini!Data percobaan penurunan.

Berikut disajikan data percobaan tentang titik beku beber...
Untuk larutan elektrolit menggunakan rumus: Keterangan: ∆T f = Penurunan titik beku. K f = Tetapan penurunan titik beku molal. n = Jumlah mol zat terlarut. p = Massa pelarut. i = Faktor Van't Hoff. Dalam bidang thermodinamika konstanta titik beku ( K f ) lebih dikenal dengan istilah "Konstanta Kriokopik".

Laporan Kenaikan Titik Didih Dan Penurunan Titik Beku Reverasite
A. Latar Belakang. Titik beku adalah suhu dimana tekanan uap cairan sama dengan tekanan uap padatannya. Titik beku larutan lebih rendah dari pada titik beku pelarut murni. Hal ini disebabkan zat pelarutnya harus membeku terlebih dahulu, baru zat terlarutnya. Jadi larutan akan membeku lebih lama dari pada pelarut.

Menentukan Rumus Molekul Senyawa dari Penurunan Titik Beku YouTube
6. Penurunan titik beku tidak bergantung pada jenis zat terlarut, tetapi hanya pada konsentarsi partikel dalam larutan. 7. Semakin banyak partikel (mengion) semakin besar sifat koligatif. B. Saran Adapun saran untuk percobaan "Penurunan titik beku" adalah sebagai berikut: 1.

Perhatikan tabel data hasil percobaan titik beku beberapa...
Seperti yang kita tahu bahwa titik beku pelarut murni berada pada suhu 0°C, tapi dengan adanya zat terlarut misalnya saja kita tambahkan gula ke dalam air tersebut maka titik beku larutan ini tidak akan sama dengan 0°C lagi, melainkan akan turun menjadi dibawah 0°C, dan inilah yang dimaksud sebagai " penurunan titik beku ". Dalam percobaan.

Penurunan Titik Beku Catatan Pak Rizal
Dalam video ini kita akan membahas: Data percobaan penurunan titik beku.Berdasarkan data tersebut dapat disimpulkan bahwa penurunan titik beku tergantung p.

Penurunan Titik Beku Larutan Dan Contoh Soal Faktasantuy Com My XXX Hot Girl
1. Titik Beku (Tf) Jadi begini , proses pembekuan itu terjadi ketika suatu zat telah mencapai titik beku. Titik beku ( Tf) akan tercapai apabila temperatur saat tekanan uap zat padat, sama dengan tekanan uap zat cair. Jika kalian mengetahui bahwa titik beku air sebesar 0ºC, itu artinya tekanan uap air dalam bentuk cair pada temperatur 0ºC.