PENYETARAAN REDOKS DENGAN CARA BILOKS UNTUK REAKSI ION (Part 1) YouTube

Soal Dan Pembahasan Penyetaraan Reaksi Redoks Dengan Metode Setengah Reaksi
Takeaways Kunci: Masalah Kimia Reaksi Redoks. Reaksi redoks adalah reaksi kimia di mana reduksi dan oksidasi terjadi. Langkah pertama dalam menyelesaikan setiap reaksi redoks adalah menyetarakan persamaan redoks. Ini adalah persamaan kimia yang harus seimbang untuk muatan dan juga massa. Setelah persamaan redoks disetarakan, gunakan rasio mol.

Soal Dan Pembahasan Penyetaraan Reaksi Redoks Dengan Metode Setengah Reaksi Rajin Belajar
Latihan Soal Penyetaraan Reaksi Redoks (Sedang) Pertanyaan ke 1 dari 5. 1. Pertanyaan. Reaksi setengah oksidasi dari reaksi berikut dalam kondisi asam adalah. . Br2 → BrO − 3 + Br −. 1. 2BrO − 3 + 6H2O + 10e → Br2 + 12OH −. 2.

Contoh soal 3, Penyetaraan Reaksi Redoks YouTube
Berdasarkan penangkapan atau pelepasan oksigen. Oksidasi: reaksi yang melibatkan penangkapan atom oksigen. Contoh: C+ O2 → CO2. Atom C (karbon) mengalami oksidasi karena dalam reaksi atom karbon mengikat atom oksigen menjadi CO2. Reduksi: reaksi yang melibatkan pelepasan atom oksigen. Contoh: H2O2 → H2O + O2.
Contoh Soal Dan Pembahasan Reaksi Redoks
Video materi dan contoh soal penyetaraan reaksi redoksLink Rangkuman, Contoh Soal Senyawa Redoks & Penyetaraan Berikut Pembahasannya: https://tanya-tanya.com.

45 Latihan Soal Penyetaraan Reaksi Redoks Pilihan Ganda Dan Jawaban Jempol kimia
Reaksi redoks (oksidasi-reduksi) adalah proses elektrokimia dimana reaksinya melibatkan hubungan antara listrik dan reaksi kimia. penyetaraan contoh soal. Menyetarakan jumlah atom dengan menambahkan H 2 O. Baca juga Laju Reaksi. Contoh Soal Reaksi Redoks. 1. Tentukan biloks dari masing-masing unsur dalam senyawa berikut. SO 4 2-NaNO 3.
Contoh Soal Dan Pembahasan Penyetaraan Reaksi Redoks
Contoh 1 Metode Setengah Reaksi dalam Suasana Asam. Perhatikan contoh berikut ini (dalam suasana asam) 1) Memisahkan reaksi redoks menjadi reaksi reduksi dan reaksi oksidasi. Bilangan oksidasi Cr pada Cr 2 O 72- = +6 sedangkan bilangan oksidasi pada Cr 3+ = +3, berarti terjadi reaksi reduksi.

Contoh soal penyetaraan reaksi redoks cara 1/2 reaksi suasana asam YouTube
Terdapat dua metode dalam menyetarakan reaksi redoks, yaitu dengan cara setengah reaksi dan cara bilangan oksidasi. Tetapi, ternyata ada cara yang lebih mudah untuk mengerjakan soal tentang reaksi redoks. Berikut adalah beberapa langkah yang harus kamu lakukan supaya bisa mengerjakan lebih mudah: Lihat reaksi redoks yang terjadi

Kumpulan Contoh Soal Penyetaraan Persamaan Reaksi Redoks Kimia Kelas 12 CoLearn halaman 9
Jawaban untuk contoh soal tersebut: Reaksi: Zn + 2HCl → ZnCl 2 + H 2 termasuk reaksi redoks, karena terjadi kenaikan dan penurunan biloks. Zn mengalami oksidasi, dan unsur H mengalami reduksi. Zn bertindak sebagai reduktor, dan HCl bertindak sebagai oksidator. Baca juga: Materi Elektrolisis. Cara Menyetarakan Reaksi Redoks

Contoh Soal 2 Penyetaraan Reaksi Redoks YouTube
Jumlahkan kedua persamaan 1/2 reaksi tersebut dengan menyetarakan lebih dahulu jumlah elektronnya : Maka koefesien berturut-turutnya untuk reaksi redoks tersebut adalah : 9. Contoh reaksi oksidasi adalah . . . a. Ag + (aq) berubah menjadi Ag (s) b.. 31 - 45 Contoh Soal Redoks dan Jawaban.
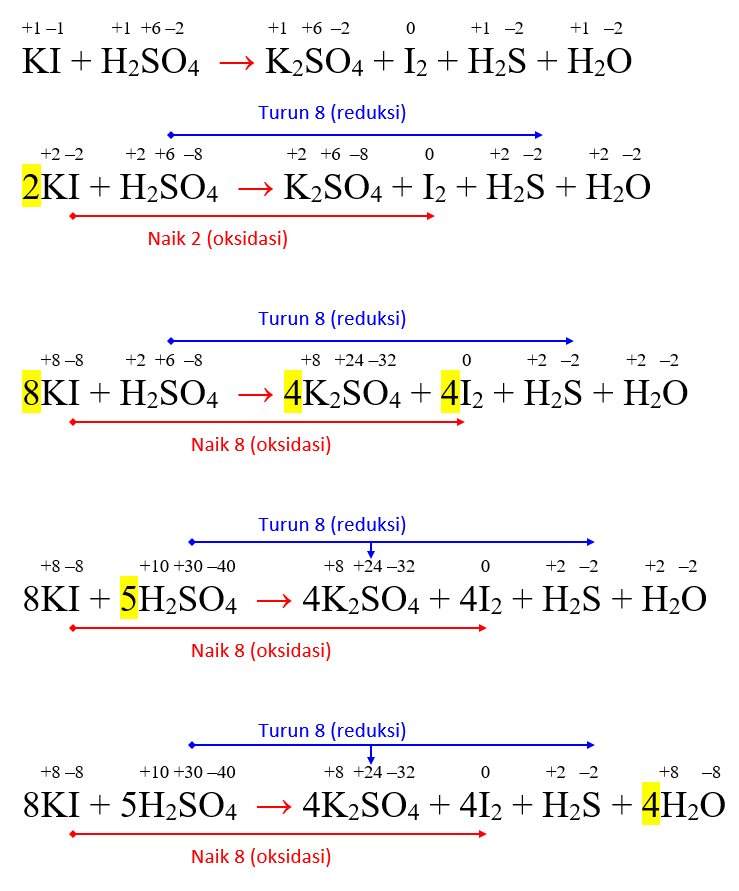
Penyetaraan Reaksi Redoks KI + H2SO4 → K2SO4 + I2 + H2S + H2O Markas Belajar
Sebelumnya Soal & Pembahasan TPA Bahasa Indonesia SBMPTN 2018. Selanjutnya Latihan Soal Laju Reaksi. 01/12/2023. 28/11/2023. Rangkuman Materi bab penyetaraan redoks kelas 12 disertai 35 contoh soal dan jawaban berikut video pembelajaran. Lengkap disini.

contoh soal penyetaraan reaksi redoks dengan cara setengah reaksi Reaksi redoks penyetaraan
Setarakan reaksi berdasarkan perubahan biloks. Samakan jumlah ion pereaksi dan hasil reaksi. Untuk lebih jelasnya, perhatikan contoh soal dan penyelesaiannya dibawah ini. Contoh soal 1. Setarakan reaksi dari Cr 2 O 72- (aq) + Fe 2+ (aq) → Cr 3+ (aq) + Fe 3+ (aq) dengan cara setengah reaksi dan bilangan oksidasi. Penyelesaian / pembahasan soal.

contoh soal penyetaraan reaksi redoks dengan metode biloks Reaksi primalangga redoks penyetaraan
Langkah 2: Setarakan unsur selain O dan H. Dalam kasus ini, hanya Cr yang perlu disetarakan. Cr 2 O 72-(aq) → 2Cr 3+(aq) HNO 2 (aq) → NO 3-(aq) Langkah 3: Tambah H 2 O untuk menyetarakan oksigen. Reaksi chromium membutuhkan 7H 2 O untuk bisa setara. Reaksi yang lain, hanya membutuhkan 1H 2 O untuk setara.

Soal Soal Ulangan Penyetaraan Reaksi Redoks Kls 12 Materi Soal
Contoh Soal No. 5. Reaksi redoks adalah suatu reaksi yang didalamnya terjadi oksidasi dan reduksi. Suatu reaksi tergolong reaksi redoks atau bukan dapat dilakukan dengan mengecek bilangan oksidasi masing-masing atom tiap senyawa yang terlibat dalam reaksi. Untuk lebih jelasnya, perhatikan 5 contoh soal reaksi redoks dan pembahasannya berikut ini!
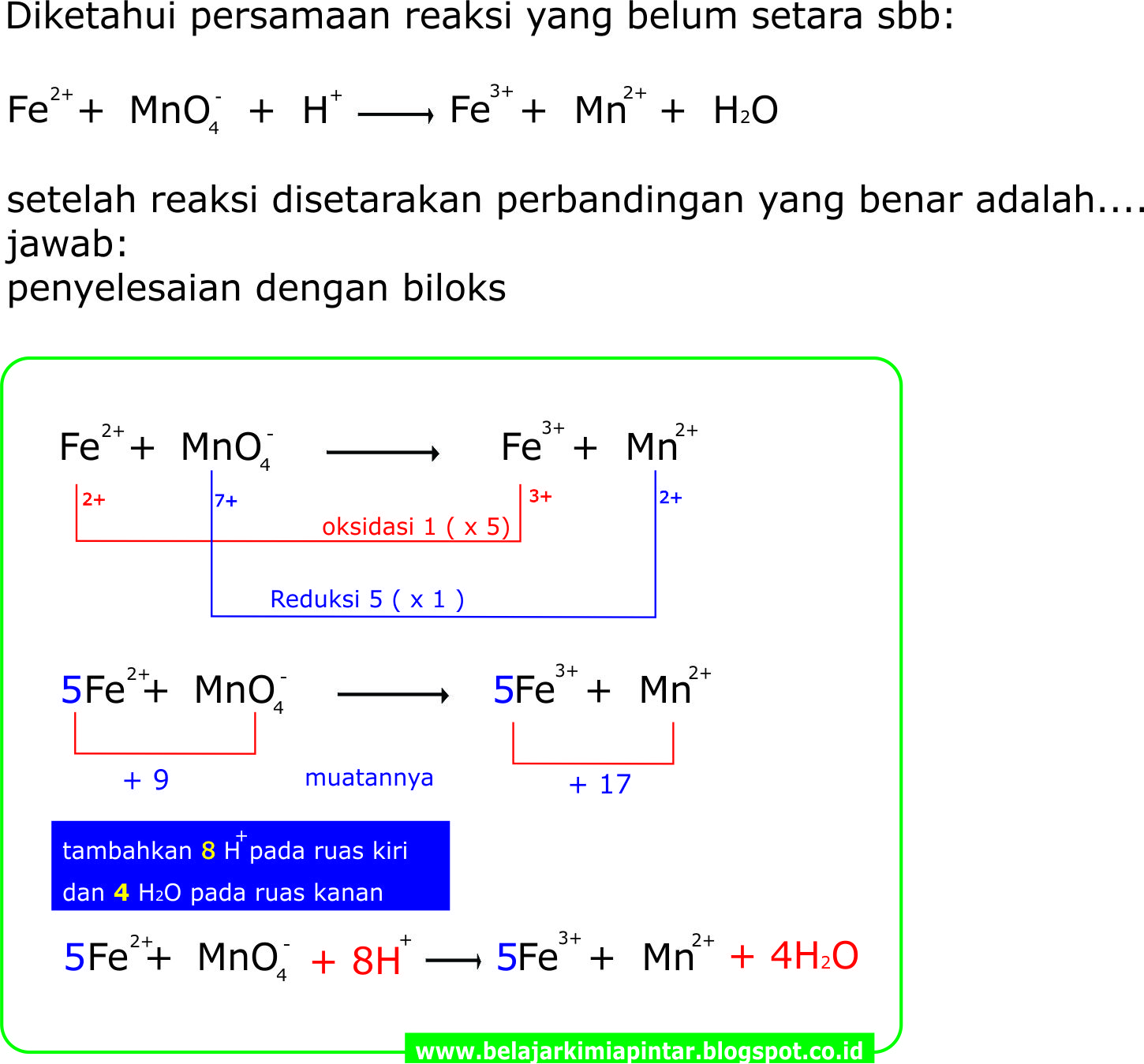
Contoh Soal Penyetaraan Reaksi Redoks Dengan Metode Biloks Berbagi My XXX Hot Girl
Soal No. 1. CuS + NO 3- → Cu 2+ + S + NO. Pisahkan persamaan reaksi tersebut menjadi dua setengah reaksi. Reaksi 1: S 2- → S. Reaksi 2: NO 3- → NO. Samakan jumlah atom. Karena jumlah atom di produk dan reaktan sudah sama maka persamaan reaksinya kita tuliskan. Reaksi 1: S 2- → S. Reaksi 2: NO 3- → NO.

Penyetaraan Reaksi Kimia Kelas 10 Cara Aljabar (Matematika) YouTube
Contoh soal Reaksi Redoks. MnO 4 − (aq) + C 2 O 4 2− (aq) → MnO 2 (s) + CO 3 2− (aq) Setarakan persamaan reaksi redoks dalam larutan suasana basa di atas dengan menggunakan metode: (a) perubahan biloks (b) setengah-reaksi. Reaksi Redoks - Referensi - Brown, Theodore L. et al. 2015. Chemistry: The Central Science (13 th edition). New.

Kumpulan Contoh Soal Penyetaraan Persamaan Reaksi Redoks Kimia Kelas 10 CoLearn halaman 4
Anda harus masuk untuk berkomentar. Untuk lebih meningkatkan pemahamanmu mengenai materi reaksi redoks, pelajarilah soal redoks pilihan ganda dan pembahasannya berikut ini. Soal No. 1 Di antara reaksi-reaksi di bawah ini yang merupakan reaksi redoks adalah.. A. CuO + 2HCl → CuCl2 + H2O B. CuO + H2 → Cu + H2O C. NaOH + Ag+ → AgOH +.